Wie man den richtigen Sekundärantikörper auswählt
Sekundäre Antikörper werden in verschiedenen Immunoassays eingesetzt, um primäre Antikörper nachzuweisen. Diese Antikörper sind an Enzyme, Biomoleküle oder Fluoreszenzfarbstoffe konjugiert, um den Nachweis der primären Antikörper zu ermöglichen. Im Gegensatz zu primären Antikörpern werden sekundäre Antikörper gegen die Spezies und den Isotyp des primären Antikörpers gerichtet und dienen dem Nachweis des primären Antikörpers durch Bindung an mehrere Stellen.
Für die erfolgreiche Auswahl des passenden sekundären Antikörpers sollten Sie folgende Faktoren berücksichtigen:
Stellen Sie eine gute Übereinstimmung sicher: Die Wirtsspezies ist das Tier, in dem der sekundäre Antikörper erzeugt wurde, und sollte sich stets vom Wirt des primären Antikörpers unterscheiden. Wenn Sie beispielsweise einen in Kaninchen erzeugten primären Antikörper verwenden, benötigen Sie einen Anti-Kaninchen-Sekundärantikörper, der in einer anderen Spezies als Kaninchen, wie z. B. Ziege, Esel oder Maus, erzeugt wurde (Abbildung 1).
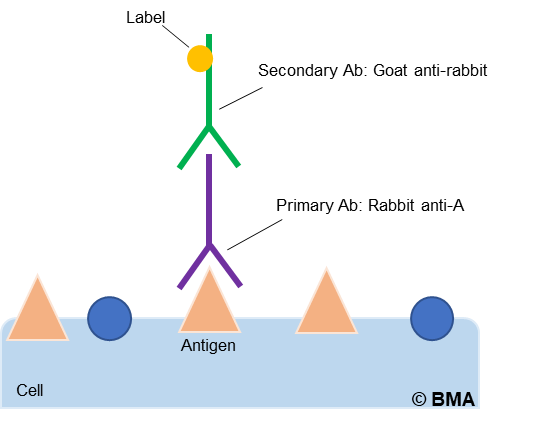
Abbildung 1: Mechanismus sekundärer Antikörper.
Ganze Antikörper oder Fragmente? – Die eigentliche Frage lautet: „Ist Ihr primärer Antikörper monoklonal oder polyklonal?“ Die Antwort auf beide Fragen hängt oft von der Anwendung ab. Monoklonale primäre Antikörper enthalten nur einen einzigen Isotyp von Immunglobulin. Daher ist es entscheidend, einen sekundären Antikörper zu verwenden, der diesen Isotyp spezifisch erkennt. Monoklonale Antikörper werden üblicherweise in Maus, Kaninchen und Ratte erzeugt. Wenn der primäre monoklonale Antikörper beispielsweise ein Maus-IgG1 ist, benötigen Sie einen Anti-Maus-IgG-Antikörper oder ein weniger spezifisches F(ab)-Fragment eines Anti-Maus-IgG-Antikörpers. Antikörperfragmente eignen sich aufgrund ihrer geringeren Größe und ihrer Fähigkeit, Gewebe zu durchdringen, am besten für die Immunhistochemie und Immunfluoreszenz. Die geringere Größe kann jedoch die Auswahl an Farbstoffen oder Enzymen, die an die Fragmente konjugiert werden, einschränken, was zu sekundären Antikörpern führen kann, die weniger sensitiv sind als vollständige Antikörper.
Polyklonale Primärantikörper enthalten eine Mischung verschiedener Isotypen von Immunglobulin G. Um den Nachweis des Zielantigens zu maximieren, empfiehlt sich daher die Verwendung eines Sekundärantikörpers, der alle Isotypen erkennt. Polyklonale Antikörper werden üblicherweise in Kaninchen, Ziegen, Schafen und Eseln hergestellt und liegen als vollständige Antikörper (schwere und leichte Ketten) vor. Daher muss die sekundäre Wirtsspezies mit einem Pool von IgG einer anderen Spezies immunisiert werden, damit die gereinigten Sekundärantikörper alle Formen erkennen können. Ist der primäre polyklonale Antikörper beispielsweise ein Ziegen-IgG, wird ein Anti-Ziegen-IgG (H+L) benötigt. Vollständige Antikörper können jedoch zu einem hohen Hintergrund und einer geringeren Spezifität führen, da die leichte Kette von allen Immunglobulinen geteilt wird, was die Kreuzreaktivität erhöht (Abbildung 2).
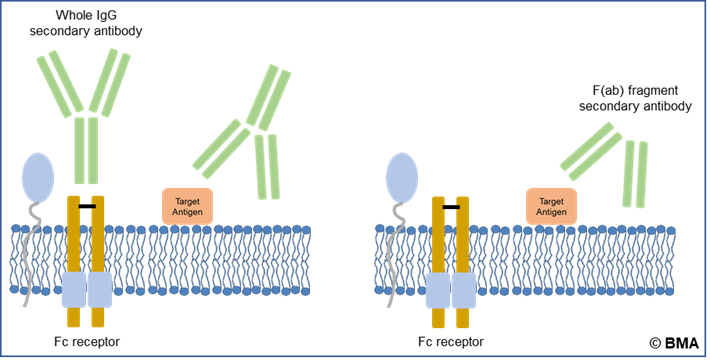
Abbildung 2: Bindungsmechanismus eines vollständigen IgG-Sekundärantikörpers im Vergleich zu einem fragmentierten Sekundärantikörper im Immunassay.
Wählen Sie das Konjugat entsprechend Ihrer Anwendung – dies hängt davon ab, wie der Sekundärantikörper das Signal detektiert. Beispielsweise verwenden Immunhistochemie, ELISA und Western Blot kolorimetrische und chemilumineszente Detektionsverfahren auf Basis von Biotinmarkierung zur Signalverstärkung und Sensitivitätssteigerung sowie enzymatische Reaktionen mit Meerrettichperoxidase (HRP) oder alkalischer Phosphatase (AP). Bei Immunmarkierung, Fluoreszenzmikroskopie und Durchflusszytometrie wird das Signal hingegen mit Fluoreszenzfarbstoffen wie Alexa Fluor detektiert, die direkt an die Antikörper konjugiert werden, um Signal und Sensitivität zu erhöhen.
Affinitätsgereinigte vs. kreuzadsorbierte Antikörper – Dieser Schritt dient der Erhöhung der Antikörperspezifität und unterscheidet zwischen Affinitätsreinigung und Kreuzadsorption. Die meisten Sekundärantikörper werden mittels Affinitätschromatographie gereinigt, was zu einem hochaffinen Antikörper führt. Antikörper dieser Art werden häufig in der Immunhistochemie (IHC) eingesetzt, da sie nur minimale unspezifische Bindungen aufweisen, sowie im Western Blot zum Nachweis von Proteinen mit geringer Konzentration. Kreuzadsorbierte Sekundärantikörper durchlaufen oft einen zusätzlichen Reinigungsschritt, um Antikörper herauszufiltern, die an andere Immunglobulin-Spezies binden. Dieser Schritt erhöht ihre Spezifität und reduziert unspezifische Hintergrundbindungen. Diese Antikörper sind für spezielle Anwendungen wie die Immunhistochemie konzipiert.
Zusammenfassend lässt sich sagen, dass die Wahl des Sekundärantikörpers von der jeweiligen Anwendung, der erforderlichen Sensitivität und Reinheit in Bezug auf die Zielproteinkonzentration sowie dem Risiko unspezifischer Bindungen abhängt. Wenn Sie die oben genannten Ansätze besprechen möchten, kontaktieren Sie uns gerne unter info@bma.ch. Wir helfen Ihnen gerne weiter!
Copyright © BMA Biomedicals 2022